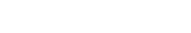张岩课题组Nature揭示黏附类受体GPR97感知糖皮质激素并激活Go的结构机制
2021年1月6日,浙江大学医学院、浙江省良渚实验室张岩研究员团队,联合山东大学孙金鹏教授团队以及中国科学院上海药物研究所徐华强研究员团队合作在Nature杂志上在线发表了他们最新的研究成果“Structures of glucocorticoid-bound adhesion receptor GPR97-Go complex”,首次鉴定并解析了糖皮质激素与其膜受体GPR97结合的复合物高分辨率电镜结构。这同时也是世界上首个解析的黏附类GPCR与G蛋白复合物的结构。

黏附类G蛋白偶联受体(Adhesion GPCRs)在GPCR超家族中是一类进化上比较古老的亚群,它又可以分为8个小的亚群,共包含33种GPCR。黏附类GPCR在生物体许多重要的生理过程中起到关键分子开关的作用,比如脑的发育、水盐调节、炎症以及细胞命运决定等,并且其突变与多种人类疾病密切相关。与GPCR超家族其它成员相比,黏附类GPCR在拓扑结构上具有明显的家族特征,其胞外区域特别长,并且具有不同功能的结构域。目前领域内普遍认为黏附类GPCR通过结合胞外的基质蛋白或者可溶性小分子激活,然而是否有小分子配体直接结合在7次跨膜核心并激活受体尚不清楚。
糖皮质激素是机体内极为重要的一类调节分子,它对机体的发育、生长、代谢以及免疫功能等起着重要的调节作用,是机体应激反应最重要的调节激素,同时也是临床上使用最为广泛而有效的抗炎和免疫抑制剂。早在1950年,美国的菲利普·肖瓦特·亨奇、爱德华·卡尔文·肯德尔和瑞士的塔德乌什·赖希施泰因便因为发现和应用糖皮质激素治疗风湿性疾病而获得了诺贝尔奖。前人大量的研究显示,糖皮质激素具有两种不同的作用模式。其中广为人知的是,糖皮质激素与其核受体结合,在细胞核内调控相关基因的表达而发挥作用,这种作用方式一般需要较长的反应时间,被称为基因组机制。除此之外,研究人员发现,糖皮质激素也能够通过快速反应的方式引起细胞和机体的变化。进一步的研究发现糖皮质激素可以与大脑突触的膜组分结合。这提示我们,糖皮质激素可能存在膜受体。随后的研究显示糖皮质激素的快速反应与G蛋白密切相关,Gi的抑制剂PTX能够抑制糖皮质激素的快速作用。因此,研究人员推测介导糖皮质激素的快速反应过程的膜受体可能是GPCR。然而,一直以来这个猜测未能确证,其快速作用的机制依然成谜。
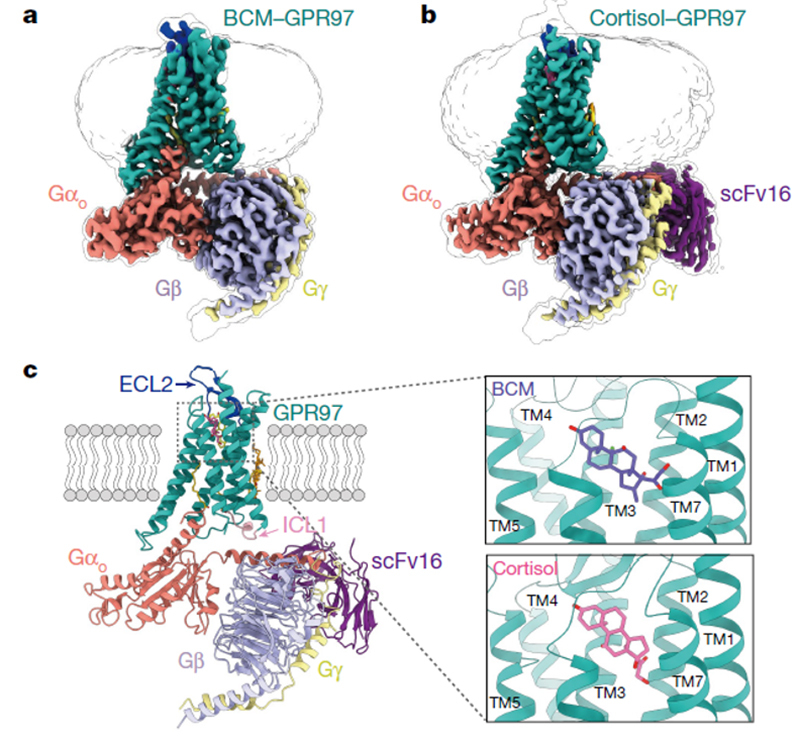
图1. GPR97-Go复合物结构
前期的研究表明治疗哮喘药物丙酸倍氯米松(BDP)能够在体外激活GPR97。BDP是糖皮质激素类药物倍氯米松(BCM)的衍生物,在17和21位有两个丙酸的修饰。基于此,团队推测糖皮质激素类化合物可能可以激活GPR97受体。随后研究团队对内源性的类固醇激素进行了系统的筛选,最终发现糖皮质激素类的氢化可的松、可的松(cortisone)以及11-脱氧皮质醇(11-deoxycortisol)能够激活GPR97。进一步的实验表明,氢化可的松能够通过激活GPR97调控Go信号通路。紧接着,团队采用单颗粒冷冻电镜技术分别对外源配体倍氯米松(BCM)以及内源性配体氢化可的松(cortisol)激活的GPR97-Go复合物进行了三维结构重构,最终分别获得了3.1 Å和2.9 Å分辨率的电镜结构(如图1所示)。
电镜结构分析表明,与其它已解析的GPCR结构相比,黏附类受体GPR97的七次跨膜螺旋呈现独特的空间分布,其螺旋的长度与其它受体也有很大的差别。前期的研究表明,黏附类GPCR的GAIN结构域和七次跨膜结构域在激活GPCR的过程中是作为一个联合的整体来发挥作用的。但出乎意料的是,研究人员在结构中发现糖皮质激素结合到了GPR97七次跨膜核心中,通过疏水作用力和氢键与呈椭球形的受体口袋结合。此外由于没有A 类GPCR家族受体保守的PIF、DRY和NPxxY motif, GPR97呈现独特的激活机制。GPR97首先通过toggle switch W6.53识别配体,借助新发现的upper Quaternary core将受体TM3-TM5-TM6捆绑在一起,然后通过HLY motif介导下游G蛋白的偶联。从胞内侧看,受体七次跨膜螺旋组成较大的张开口袋,3个胞内环都参与了受体与G蛋白的相互作用,胞内环与受体的组成性激活高度相关,某些重要互作氨基酸的突变,能显著降低受体的自激活能力。
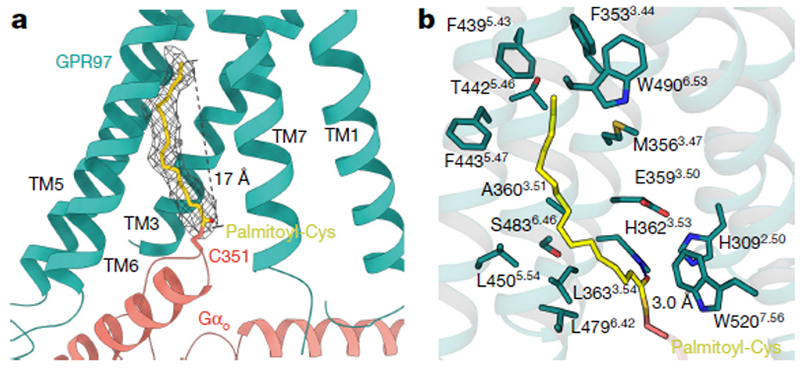
图2 Go棕榈酰化修饰
意外的是,分析冷冻电镜密度图发现在Gαo-α5螺旋的C351位点存在棕榈酰化修饰(如图2所示)。这是目前首次在GPCR-Gi/o复合物结构中发现此修饰。目前学术界普遍认为C351位点的翻译后修饰会导致Gi/o信号通路的功能丧失。而我们这里的功能研究表明,Gα C351位棕榈酰化修饰对黏附受体GPR97的G蛋白偶联及其下游信号转导起到促进作用,颠覆了目前的认知,是对Gi/o信号通路精细调控的重要补充。
图3 糖皮质激素信号途径
综上所述,本研究首次发现了糖皮质激素的高亲和力膜受体(图3),并通过单颗粒冷冻电镜技术解析了黏附类受体GPR97在糖皮质激素的激活下与Go蛋白复合物结构,从而在原子分辨率上阐述了糖皮质激素如何结合并激活该受体,从而介导下游G蛋白的偶联。该成果无论是对糖皮质激素膜受体的功能研究还是黏附类GPCR激活机制的理解都起到了重要的推动和示范作用。
本课题为浙江大学张岩研究员团队,山东大学孙金鹏教授团队以及中科院上海药物所徐华强研究员团队联合攻关的成果。上海药物研究所与山东大学基础医学院联合培养博士生平玉奇、浙江大学基础医学院博士后毛春友、山东大学基础医学院副教授肖鹏、硕士研究生赵儒嘉、上海药物研究所蒋轶研究员为本文共同第一作者;浙江大学基础医学院张岩研究员、山东大学孙金鹏教授、上海药物研究所徐华强研究员为共同通讯作者。张岩课题组博士生张会冰、科研助理沈丹丹和博士后沈庆亚也深度参与了本工作,做出了重要贡献。
张岩研究员获得国家科技部重点研发计划青年项目、国家自然科学基金委优秀青年科学基金、浙江省自然科学基金委杰出青年科学基金等项目的大力支持。冷冻电镜数据收集在浙江大学冷冻电镜中心完成。